巨噬细胞是机体免疫系统的重要细胞成分,具有抗感染、抗肿瘤和参与免疫应答、免疫调节等生物学功能,是研究细胞吞噬、细胞免疫和炎症的重要对象。
巨噬细胞的极化
巨噬细胞具有异质性和多样性,可在不同的组织微环境和生理病理条件下,转化为不同的表型,称为巨噬细胞的极化。
巨噬细胞组织分布多样性和异质性的特点,使之一直以来都是科研工作者们热门研究的对象。
根据细胞表面标记分子、细胞因子分泌及代谢相关基因特征,巨噬细胞通常被分为经典活化的M1型巨噬细胞(促炎)和选择性活化的M2型巨噬细胞(抗炎)。
■ M1型巨噬细胞表达MHC II、CD80、CD86和 CD16/32,分泌TNF-α、IL-6和IL-12等促炎因子,以及CXCL9、CXCL10和CXCL11等趋化因子。
■ 另外,M2型巨噬细胞高表达arginase-1(Arg1)和CD206,分泌抗炎因子IL-10以及CCL2、CCL17和CCL22等趋化因子。
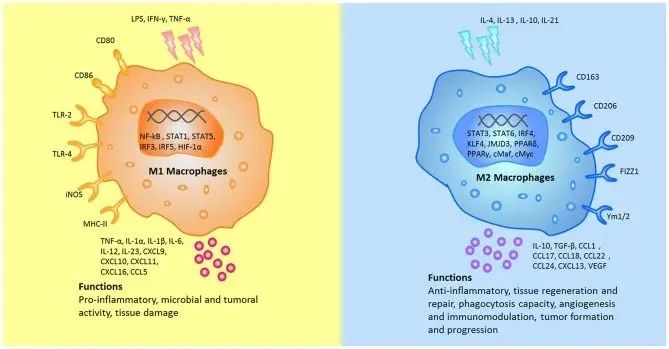
(DOI: 10.3389/fimmu.2019.00792)
巨噬细胞极化的体外研究,通常使用脂多糖(LPS)和干扰素(IFN-γ)等TLR激动剂诱导M1型极化,使用IL-4或IL-13等诱导M2型极化,然后记录基因表达、细胞表面标志物及蛋白质含量和活性的变化。
原代小鼠巨噬细胞可以从多个部位获得:比如骨髓、腹腔、肺或脂肪组织等。目前巨噬细胞的分离的方法主要包括贴壁筛选法、密度梯度离心法、酶消化法、流式细胞仪分离法等。
下面具体介绍小鼠腹腔巨噬细胞和骨髓来源巨噬细胞的提取和分离。
腹腔巨噬细胞提取
巨噬细胞天然存在于小鼠腹腔,腹腔巨噬细胞多游离存在于腹水中易于获得:用生理盐水或细胞培养基冲洗腹腔后抽取腹腔灌洗液体,即可获取其中的巨噬细胞。
以下为具体实验方案:
(1)巨噬细胞的诱导
在实验前3天,连续3天给小鼠腹腔注射1mL的3%巯基乙酸盐肉汤,每天1次。(肉汤刺激是非感染性炎症刺激,能促进巨噬细胞的聚集)
注:
■ 腹腔注射是关键,给肉汤时记得回抽,切记不能刺到器官导致小鼠腹腔出血,否则会使提取的巨噬细胞不纯。
■ 硫乙醇酸盐的作用是将巨噬细胞由外周血中释放入腹腔中,可提取更多的巨噬细胞用于实验,腹腔巨噬细胞多为M1促炎型。
(2)3天后,收集巨噬细胞
① 处死小鼠
准备75%乙醇,小鼠麻醉后,以脱颈方式处死小鼠,将小鼠置于75%乙醇中浸泡3-5min进行灭菌消毒处理后(注:使小鼠的腹腔朝下浸没在酒精中),移入超净台,仰卧位固定小鼠。
② 暴露腹膜
将小鼠外皮拉起,沿腹部剪开一个小口(注意勿将腹膜剪破),再剪开整个腹部皮肤,捏住两侧皮肤慢慢向两边撕开,使腹膜暴露。
③ 向腹腔注射生理盐水或细胞培养基:
于右下腹部将5mL预冷的PBS(或5mL预冷的10%血清RPMI-1640培养液)缓缓注入腹腔(注意不要抽进空气),轻揉小鼠腹部数次,静置3-5min,使液体在腹腔内充分流动。
注:
■ 腹腔注射直接会接触表皮,易污染,此步骤需要多加注意。
■ 腹腔注射培养基后,按压动作要轻柔缓慢,以防培养基从针孔溢出。
④ 抽取腹腔液,转移至离心管中(反复冲洗腹膜腔灌洗液2次)。
(3)巨噬细胞的纯化与培养
将收集的腹腔灌洗液于常温条件下1000r /min 离心5min,弃去上清,所得细胞沉淀用RPMI-1640培养液重悬接种,培养体系于37℃静置培养2~3h后,洗去未贴壁细胞,余下的贴壁细胞即为巨噬细胞。
注:由于腹腔巨噬细胞的粘附能力不强,清洗的时候动作要尽可能轻。
注意事项
■ 小鼠腹腔注射刺激物时不要刺破内脏,可以在操作过程中将小鼠头部向下抓取,使其腹部内容物滑向膈下以避开注射器针头;
■ 若回收的小鼠腹腔灌洗液过少,可另外注入预冷的PBS重复灌洗;
■ 若不小心致腹腔出血,可在腹腔液离心后重悬时加入5倍细胞悬液体积的红细胞裂解液,再次离心弃上层红色液体。
■ 尽量避免被小鼠咬伤或吸过小鼠腹腔液的针头扎伤,一旦被咬伤或扎伤,要到专门机构尽快注射出血热疫苗,如果创面大,需同时注射破伤风疫苗。
骨髓来源巨噬细胞的提取
在原代巨噬细胞的获取中,直接分离的腹腔巨噬细胞(或者肺泡巨噬细胞)数量有限,在未经诱导时,每只小鼠只能获取1.5-3×106个腹腔巨噬细胞,不能满足某些实验的需求,因此骨髓诱导分化的巨噬细胞(Bone marrow-derived macrophages,BMDM)是目前实验室最常用的分离小鼠巨噬细胞的选择。
以下为具体实验方案:
(1)诱导因子的获取
M-CSF是一种诱导骨髓细胞向M2型巨噬细胞分化的诱导因子,获取的途径有两种:
1)找商业化的细胞因子产品直接购买,但不同厂家的细胞因子活性差异较大,需仔细甄别。M-CSF的使用浓度在20-50ng/mL即可。
2)自己培养能够分泌这种细胞因子的细胞,其中L929细胞上清含有较高活性M-GSF以及其它多种细胞因子,比如VEGF、MCP-1、MIG、IL-9/10等。该培养体系可以在短时间内获得大量巨噬细胞样的细胞,并且该体系不适合其它细胞生长,因而其它各系细胞会逐步死亡,经换液去除悬浮细胞后,最终可以获得大量纯化的骨髓巨噬细胞样细胞。
(2)骨髓巨噬细胞的分离
1)取腿骨
准备75%乙醇,小鼠麻醉后,脊髓脱臼法处死小鼠,将小鼠置于75%乙醇中浸泡5min进行灭菌消毒处理;
转移到超净工作台,固定小鼠上肢,用剪刀从腹部中线剪开,取其双侧股骨和胫骨,剔除骨上附着的肌肉和组织(注意:应尽量将肌肉组织去除,只留下骨头,整个过程务必保持股骨及胫骨的完整性!)
将去皮去肉的股骨、胫骨放置在含有75%乙醇的培养皿内浸泡5min(注:75%乙醇对骨髓细胞没有影响,但尽量要控制在5 min之内),然后用冷的PBS浸泡,洗去胫骨、股骨表面的乙醇,5min。
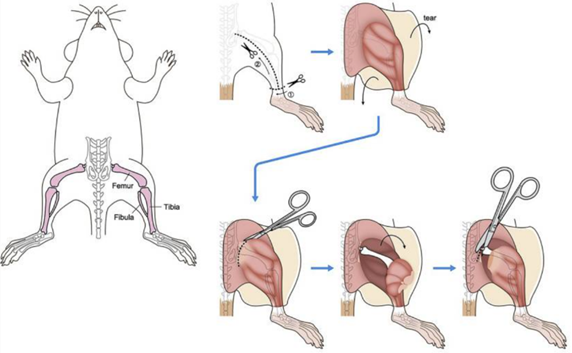
(DOI: 10.1016/j.xpro.2020.100246)
2)骨髓巨噬细胞提取和诱导
将清洗好的股骨、胫骨分开,并用剪刀分别将股骨、胫骨两端剪断,使用1-2mL注射器吸取冷的诱导培养基将骨髓从股骨、胫骨中吹出,反复吹洗3次,直至骨内看不到明显的红色为止。
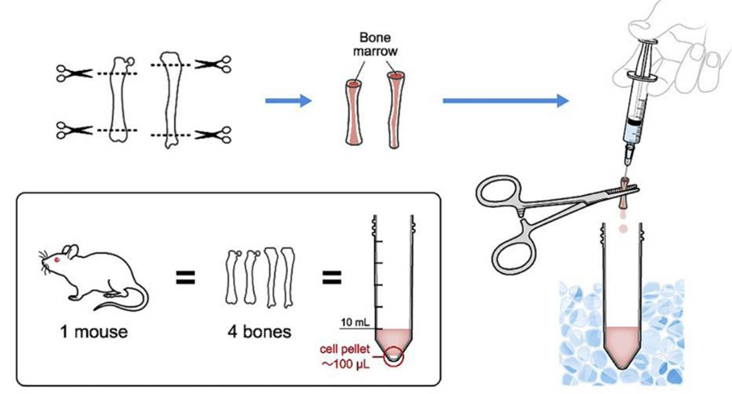
(DOI: 10.1016/j.xpro.2020.100246)
此时可能会有红色条状物质,这是聚集的骨髓细胞,用5mL移液枪将含有骨髓细胞的培养基反复吹打,将块状的细胞团吹散。
然后使用70μm细胞滤器将细胞过筛,转移至15mL离心管中,1500rpm/min离心5min,弃上清。
加入红细胞裂解液重悬,轻弹管底,混悬细胞沉淀,静置5min后,加入10 mL 冰PBS进行洗涤,4°C,1500rpm/min离心5min,弃上清(必要时重复,直至细胞团块红色部分明显减少),用冷的配置好的骨髓巨噬细胞诱导培养基重悬,铺板。
细胞培养期间,每隔2-3天更换新鲜骨髓来源巨噬细胞培养基,加入培养基前用PBS清洗细胞,培养7天后收集细胞。
注意事项:
■ 骨髓巨噬细胞不可传代,不可以用胰酶消化,使用时可用细胞刮直接刮下来或者用枪吹打下来,然后离心计数即可用于实验。
■ 建议直接铺板用于后续实验,更换培养容器会损伤细胞。
■ 细胞诱导成功后要及时使用,不宜长时间培养。
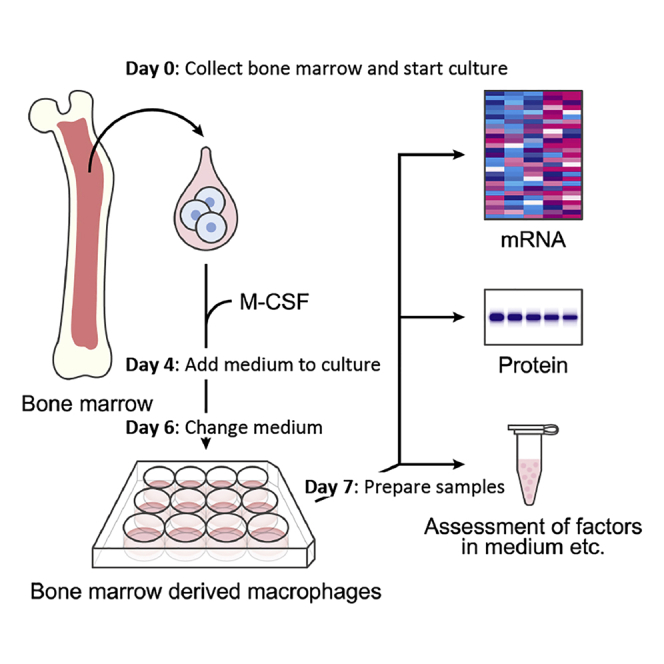
(DOI: 10.1016/j.xpro.2020.100246)
参考来源:
【1】Isolation and Differentiation of Murine Macrophages,DOI: 10.1007/978-1-4939-6625-7_23
【2】Preparation and culture of bone marrow-derived macrophages from mice for functional analysis,DOI: 10.1016/j.xpro.2020.100246














